距IPO申请被受理已近两年时间,南通联亚药业股份有限公司(以下简称联亚药业)仍在问询阶段。日前,联亚药业更新2023年年报财务数据。
作为一家主营以仿制药为主的企业,联亚药业选择科创板上市,引发监管对科创板定位的重点关注,多次问询科创板定位、科创属性。此外,涉及公司第一大股东Ingenus的相关问题也多次被监管问询。
科创板定位多次被问
根据招股书描述,联亚药业是一家研发驱动型的高新技术产业,主要从事复杂药物制剂的研发、生产和销售,目前产品主要包括以不同类型的缓控释制剂以及极低剂量药物制剂为代表的两大高端仿制药。
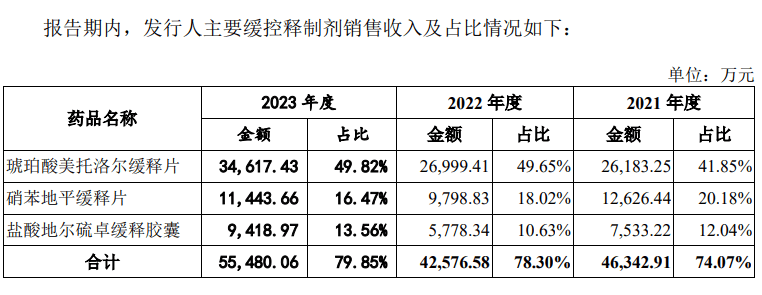
实际上,联亚药业旗下产品主要为仿制药,主要为琥珀酸美托洛尔缓释片、硝苯地平缓释片、盐酸地尔硫卓缓释胶囊、口服避孕药等产品。
从收入占比看,前述四款产品近90%。2019年至2021年,四款产品收入占比为87.86%、85.1%、95.47%。
其中,仅琥珀酸美托洛尔缓释片一款产品收入产品就常年超过40%。2021年至2023年,该产品收入分别为2.62亿元、2.7亿元、3.46亿元,占比分别为41.85%、49.65%、49.82%。琥珀酸美托洛尔缓释片主要用于治疗高血压、心绞痛以及伴有左心室收缩功能异常的症状稳定的慢性心力衰竭等,属于处方药物。
而这也引起监管层关注,在第一轮问询中,上交所首个问题便是针对科创板定位。此后在第二轮问询、第三轮问询中都对科创属性、技术先进性和未来业务发展作出问询。上交所要求联亚药业结合相关情况说明以专利挑战获批上市作为产品技术先进性体现的依据是否充分,要求其结合说明发行人是否符合科创板定位并提供进一步依据。
联亚药业认为,原研药具有较高仿制难度,挑战专利对发行人的制剂技术和设计能力提出较高要求。联亚药业共有5个产品通过“挑战专利”获FDA批准上市,认为产品通过挑战专利上市后可迅速占据主要市场。
联亚药业以盐酸二甲双胍缓释片为例予以说明。2018年11月,该产品通过挑战专利获批上市,上市第二年即取得较高市占率,后续原研药专利过期后产品市占率随之下降。数据显示,2019年该产品市占率为25%,2020年即上升至51.4%。
大客户Ingenus获重点关注
除科创板定位外,大客户Ingenus也成为监管关注重点,上交所在多轮问询中均有关注。
招股书显示,Ingenus是联亚药业第一大客户,而且Ingenus享有公司主要产品琥珀酸美托洛尔缓释片、硝苯地平缓释片等于美国市场的独家经销权。2019年至2022年1季度各期间,公司向Ingenus销售收入占当期营业收入的比例分别为78.14%、78.34%、77.09%和85.90%。
Ingenus为一家注册于美国的集研发、生产及销售于一体的综合型药企,主要从事仿制药的开发、制造和商业化,致力于通过仿制药以提高药品的可及性以及降低医疗开支,经营产品涉及120余种类、规格的仿制药,覆盖高血压、冠心病、糖尿病、女性避孕及健康等领域,并重点关注透皮、半固体、注射和缓控释等创新剂型。
上交所要求联亚药业就选择Ingenus而非直接与美国大型医药流通企业建立合作的原因及合理性、排他性条款对公司产品销售的影响及是否符合行业惯例、Ingenus是否存在单方面解除协议的权利并分析披露对公司与其合作稳定性、业务持续性的影响等问题进行说明。
联亚药业解释,经多年发展,公司与经销商形成了稳定的合作关系,Ingenus以及美国大型医药流通企业McKeddon的子公司均为公司直接客户,因Ingenus经销产品销售占比高故而成为公司第一大客户。
联亚药业认为,与国外当地经销商合作,充分发挥其熟悉所在国医药市场体系的优势,以有效开拓海外市场是我国制药企业出海拓展国际市场的重要方式之一。发行人授予 Ingenus独家经销权符合行业惯例,
联亚药业自2013年便与Ingenus合作,联亚药业认为双方已实现了较长时间的稳定合作,陆续签订了包含经销、产品开发与商业化及研发咨询服务等多类协议。Ingenus经销的发行 人制剂种类不断增加,受理ANDA申请后能及时取得上市批准,主要产品取得了领先的市场份额,合作内容也扩展至共同进行新产品的开发,双方保持了稳定良好的合作关系。
联亚药业表示,报告期内,发行人均严格按照约定交付产品,为Ingenus的销售提供了可靠稳定的供货保障,未曾发生上述事项,且合理预计未来发生该等情况的可能性较小。
【免责声明】本文仅代表作者本人观点,与和讯网无关。和讯网站对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。请读者仅作参考,并请自行承担全部责任。邮箱:[email protected]














